- HÉLIUM ET GAZ RARES
- HÉLIUM ET GAZ RARESL’hélium, le néon, l’argon, le krypton, le xénon et le radon forment la famille des gaz rares, groupe zéro de la classification périodique des éléments chimiques. Tous monoatomiques, ces gaz sont caractérisés par leur très grande inertie chimique, d’où les qualificatifs de nobles ou d’inertes qui leur sont quelquefois donnés. Cette remarquable inertie s’explique par l’existence d’une couche électronique extérieure saturée, à deux électrons pour l’hélium, à huit pour les autres, configuration similaire à celle de nombreux ions stables (théorie de l’octet).Les gaz rares ont une affinité électronique presque nulle et des potentiels d’ionisation extrêmement élevés. En conséquence, dans des conditions normales, ils ne gagnent ni ne perdent d’électrons et ne forment pas de liaisons: les seules forces qui lient les atomes entre eux sont des forces de Van der Waals. Ces gaz sont caractérisés par des points de fusion et d’ébullition très bas, ce qui, dans le cas de l’hélium, permet d’atteindre des températures très voisines du zéro absolu. L’hélium présente la particularité de n’exister à l’état solide que sous pression et de présenter à l’état liquide deux phases, dont une, l’hélium II, a des propriétés de superfluidité qui n’appartiennent à aucune autre substance.Produit de la désintégration du radium, le radon est lui-même radioactif: il se dégrade en polonium avec une période inférieure à quatre jours. Les autres gaz rares sont stables. Leurs principales utilisations (essentiellement celles de l’argon et de l’hélium) sont la création d’atmosphère neutre pour la soudure à l’arc de l’aluminium, du magnésium, des aciers inoxydables, du titane, et pour l’élaboration de certains métaux.1. L’héliumEn 1868, Jules Janssen et Joseph Norman Lockyer observèrent indépendamment une raie jaune nouvelle dans le spectre solaire. Georges Rayet eut l’idée que cette raie pouvait être émise par un élément inconnu, mais ce furent Edward Frankland et J. N. Lockyer qui en firent la preuve, et ils appelèrent cet élément hélium (du grec 兀凞晴礼﨟, soleil ).C’est seulement en 1895 que William Ramsay découvrit l’hélium dans un minerai uranifère, la clévéite, et le classa parmi les éléments terrestres. La même année, Heinrich Kayser détecta sa présence dans l’atmosphère.État naturel, production et utilisationL’hélium (symbole He) entre continuellement en très faible quantité dans l’atmosphère sous forme de particules alpha des rayons cosmiques. Il est produit, également sous forme de particules alpha, par la désintégration de plusieurs éléments radioactifs dans la croûte terrestre; l’hélium ainsi formé chemine à travers la lithosphère et passe soit dans l’atmosphère, soit dans certaines poches de gaz naturels. Les atomes d’hélium ont une masse très faible et peuvent échapper partiellement à l’attraction de la Terre. Il s’est établi un équilibre entre les pertes et les gains d’hélium par l’atmosphère, où sa concentration est constante: 5,3 cm3 d’hélium par mètre cube d’air.L’hélium accumulé dans les poches de gaz naturels constitue la réserve la plus importante; c’est une valorisation non négligeable du gaz naturel. Les sources les plus connues sont situées aux États-Unis, près d’Amarillo (Texas). Des sources sont exploitées également en Pologne et au Canada (Saskatchewan).L’hélium est extrait du mélange de gaz en liquéfiant sous pression à basse température successivement tous les constituants sauf l’hélium. Les impuretés que contient la phase ultime sont éliminées par adsorption sur du charbon actif à la température de l’azote liquide. Actuellement, plusieurs installations comprennent en plus un cycle de liquéfaction de l’hélium qui est alors transporté à l’état liquide dans des citernes atteignant 30 m3.Aux États-Unis, la production de l’hélium a été entièrement sous le contrôle du Bureau of Mines jusqu’en 1958. Depuis cette date, l’industrie privée participe à l’extraction, mais une grande partie de l’hélium n’est pas séparée et part avec le gaz naturel. En 1968, environ 200 millions de mètres cubes d’hélium sont sortis des puits, alors qu’il suffisait d’en extraire le septième pour satisfaire aux besoins. Pour éviter de perdre de manière irréversible cet hélium (les réserves d’hélium récupérable aux États-Unis sont estimées à 4,3 milliards de mètres cubes), le gouvernement a inauguré un programme de conservation qui consiste à renvoyer après séparation l’hélium brut dans des poches de gaz épuisées.L’utilisation de l’hélium pour les aérostats (poussée 7,5 p. 100 plus faible qu’avec l’hydrogène) est actuellement tout à fait secondaire; son emploi dans les programmes spatiaux comme gaz de pressurisation est devenu prépondérant. L’hélium est relativement transparent aux particules nucléaires et ne devient pas radioactif; ces propriétés en font un agent de transfert de chaleur idéal pour les réacteurs nucléaires. En outre, il est utilisé dans la soudure à l’arc sous atmosphère neutre de l’aluminium, de l’acier inoxydable, du titane, etc., et pour l’élaboration de certains métaux.La faible solubilité de l’hélium dans le sang et son grand coefficient de diffusion permettent de le mélanger à l’oxygène pour constituer une atmosphère respirable lorsque le corps risque d’être soumis à de brutales décompressions. De plus, ses effets narcotiques sont beaucoup plus faibles que ceux de l’azote. Dans le domaine des techniques cryogéniques, l’hélium 4 liquide et l’hélium 3 sont couramment utilisés.Propriétés physiques et chimiquesLe noyau de l’hélium (2 neutrons et 2 protons) constitue la particule alpha émise lors de certaines réactions nucléaires. Son atome possède deux électrons et seules les forces de Van der Waals sont disponibles pour assurer des liaisons entre atomes. Il présente le caractère d’inertie chimique commun à tous les gaz rares. À température ambiante, c’est un gaz inodore, incolore, sept fois plus léger que l’azote.L’hélium à basse températureÀ l’état condensé, à basse température, les propriétés de l’hélium diffèrent singulièrement de celles de toutes les autres substances. En particulier, en équilibre avec sa vapeur, il reste liquide jusqu’au zéro absolu de température, et ne peut être solidifié que sous pression (25 atmosphères à 0 K).Dans tout solide, les atomes subissent autour d’une position moyenne des mouvements désordonnés de vitesse et d’amplitude de plus en plus faibles au fur et à mesure que la température décroît. La mécanique quantique nous apprend cependant que même à 0 K, quand toute l’énergie thermique liée à la capacité thermique est enlevée, c’est-à-dire dans l’état fondamental, les atomes conservent des oscillations autour de leur position moyenne. L’énergie résiduelle correspondante, égale à h 益/2, où h est la constante de Planck et 益 la fréquence des oscillations, est appelée énergie de point zéro . Les forces d’interactions étant très faibles dans le cas de l’hélium, cette énergie empêche les atomes de s’approcher suffisamment pour former un solide, même à 0 K. On ne peut donc obtenir le solide qu’en aidant les forces d’interactions par une pression extérieure. D’après le troisième principe de la thermodynamique, les deux phases solide et liquide doivent avoir une entropie nulle au zéro absolu de température, et sont alors parfaitement ordonnées.Hélium I et hélium IIL’énergie de point zéro explique aussi le point critique particulièrement bas de l’hélium (5,20 K; 2,29 bars) et sa faible masse volumique (0,125 g/cm3 au point normal d’ébullition de 4,22 K), mais non la transition sans chaleur latente que l’on observe dans le liquide à la température de 2,17 K appelée point. À cette température, la capacité thermique et le coefficient de dilatation présentent une discontinuité. Il se produit une transition entre deux phases du liquide; la phase à basse température, plus ordonnée, est appelée hélium II, et la phase existant au-dessus du point l’hélium I.En arrivant au point, le liquide cesse brusquement de bouillir avec formation de bulles dans la masse. La conductibilité thermique apparente de l’hélium II est si grande (dans certaines conditions de mesure elle atteint 2 000 fois celle du cuivre à 300 K) qu’il est impossible de créer des différences de températures appréciables dans le liquide; l’évaporation n’a lieu qu’en surface.La viscosité de l’hélium II n’obéit pas aux lois classiques des fluides visqueux: elle a une valeur normale dans certaines mesures, elle est nulle lorsqu’on la détermine par écoulement de fluide à faible vitesse à travers des capillaires très fins; d’où le qualificatif de superfluide donné à l’hélium II.Une éprouvette plongée partiellement dans un bain d’hélium II se remplit ou se vide lentement de telle manière que les niveaux s’égalisent toujours. Le transfert se fait par l’intermédiaire d’un film d’environ 3 練 10-8 m d’épaisseur qui recouvre toute surface en contact avec l’hélium. Ce film peut se déplacer sans frottement avec une vitesse atteignant 0,3 m/s.Dans un modèle simplifié basé sur la «condensation» d’un gaz obéissant à la statistique de Bose-Einstein, on considère l’hélium II comme un mélange de deux fluides, l’un constitué d’atomes «normaux» qui possèdent toute l’énergie thermique du système, l’autre d’atomes «condensés» dans le plus bas niveau d’énergie qui se déplacent sans frottement et transportent une entropie nulle.Lorsqu’on dégage de la chaleur dans l’hélium II, on transforme des atomes superfluides en atomes normaux. À cause de la mobilité du superfluide, il se produit un courant de superfluide vers la source de chaleur, qui doit être compensé par un courant inverse de fluide normal. Dans le cas d’un tube dont la partie inférieure plongée dans l’hélium II est bouchée par des capillaires ou de la poudre d’émeri, le mouvement des atomes normaux est gêné vers le bas si bien qu’en chauffant le tube on peut avoir un jet d’hélium à la partie supérieure (effet fontaine).Hélium 3Il existe deux isotopes radioactifs de l’hélium 4: l’hélium 5 et l’hélium 6, dont les durées de vie sont inférieures à la seconde, et un isotope stable: l’hélium 3, de masse atomique 3,016. Celui-ci est présent en quantité très faible dans l’hélium naturel: 1 atome par million dans l’hélium de l’air et dix fois moins dans celui extrait des gaz naturels. Il est fabriqué dans des réacteurs atomiques par bombardement du lithium avec des neutrons.L’hélium 3 a une énergie de point zéro plus grande que celle de l’hélium 4 à cause de sa plus faible masse atomique. Cela explique le point d’ébullition de 3,2 K avec une masse volumique de 0,07 g/cm3 et la pression de solidification de 34 bars à 0 K. Il possède un moment magnétique, n’obéit pas à la statistique de Bose-Einstein mais à celle de Fermi-Dirac. Il présente un autre type de superfluidité que l’isotope 4 au-dessous de 2,7 mK [cf. SUPERFLUIDITÉ].Dans l’hélium 3 solide, les moments magnétiques nucléaires ne peuvent s’orienter qu’à des températures de l’ordre du millième de degré absolu. Au contraire, dans le liquide les moments commencent à s’orienter mutuellement dès 1 K. Au-dessous de 0,32 K, l’état d’ordre du liquide devient donc plus grand que celui du solide, ce qui est un cas unique. Cela se traduit par un minimum de la courbe de solidification à cette température, et l’on peut obtenir un abaissement de température par compression adiabatique faisant passer de l’état liquide à l’état solide au-dessous de 0,32 K.L’hélium 3 est miscible en toute proportion dans l’hélium 4, son influence primordiale étant d’abaisser la température du point. Mais au-dessous d’une certaine température critique fonction de la concentration (maximum 0,87 K pour 67 p. 100 d’hélium 3), le mélange se sépare spontanément en deux phases, et la plus riche en hélium 3 surnage. À 0 K la phase supérieure est de l’hélium 3 pur et la phase inférieure est de l’hélium 4 contenant 6,37 p. 100 d’hélium 3.2. Les autres gaz raresL’argon, le krypton, le xénon et le néon ont été découverts dans l’atmosphère terrestre: l’argon par William Ramsay et lord Rayleigh en 1894; le krypton, le xénon et le néon par W. Ramsay et Morris Williams Travers en 1898. Le radon a été découvert par Ernst Dorn en 1900 dans les produits de désintégration du radium.Propriétés physiquesCe sont des gaz incolores, inodores et sans saveur, très difficiles à liquéfier. Leurs principales propriétés physiques sont données dans le tableau. La conductivité thermique de l’argon, plus faible que celle de l’azote, le fait utiliser dans les lampes électriques à filament incandescent: la température étant plus élevée, la lumière est plus blanche qu’avec une atmosphère d’azote. Cette qualité est encore renforcée avec un mélange, plus coûteux, de krypton et de xénon. Les tubes dits «au néon» sont des tubes à décharge à haute tension renfermant des mélanges de gaz rares sous une très faible pression (quelques millièmes de millimètre de mercure). Ce sont alors les propriétés spectrales des gaz qui interviennent. La couleur obtenue dépend du gaz: bleu verdâtre pour l’argon associé à de la vapeur de mercure, rose pour l’hélium, rouge orangé pour le néon, bleu pâle pour le krypton, bleu vert pour le xénon; ces teintes peuvent être modifiées en mélangeant les gaz. Enfin, les tubes dits fluorescents, de plus en plus employés pour l’éclairage, renferment une atmosphère d’argon.Propriétés chimiquesDès la découverte de l’argon, Ramsay et Rayleigh tentèrent sans succès de combiner cet élément. De nombreux chercheurs, refusant d’admettre la théorie de l’octet, essayèrent, par l’expérience ou le calcul, de réaliser et de prévoir des réactions avec les autres éléments.A. von Antropoff, en 1924, fut l’un des premiers à suggérer l’existence possible de composés de gaz rares en les considérant comme ayant une valence maximale égale à huit. C’est ensuite Linus Pauling qui, en 1933, envisagea l’éventualité de former des fluorures et des sels oxygénés. Cette même année, D. Yost et A. L. Kaye furent tout près de réussir en irradiant un mélange de xénon et de chlore, mais malheureusement ils n’étendirent pas leur méthode au fluor, lequel était, à l’époque, d’une manipulation très délicate.Finalement, excepté quelques clathrates et de nombreuses combinaisons métalliques, aucun composé vrai ne fut isolé et, en 1962, les gaz rares devaient encore être considérés comme vraiment «inertes».C’est alors que N. Bartlett obtint le premier composé vrai du xénon, l’hexafluoroplatinate, qui fut à l’origine de la chimie des gaz rares. Mis à part le radon, qui est radioactif, et le krypton, qui a quelques composés (KrF2; Kr4; Kr2, 2 Sb5; Kr24Ba), cette chimie est entièrement celle du xénon; en effet, toutes les tentatives pour faire entrer l’hélium, l’argon et le néon dans une combinaison chimique se sont soldées par un échec.La conséquence principale de la découverte de ces composés a été une évolution et une adaptation de la théorie de la «liaison chimique». En ce qui concerne leurs utilisations, on a eu quelques espoirs: l’existence de fluorures de xénon indiquait une technique possible pour séparer le xénon du krypton, et extraire le xénon radioactif qui prend naissance dans les piles atomiques; par ailleurs, certains composés (XeO3; Xe4) sont doués de propriétés explosives. Mais la relative rareté du xénon et par suite le prix de revient de ses composés, alliés à la difficulté de leur manipulation, ruinèrent beaucoup de ces espoirs. L’intérêt essentiel réside dans leurs importantes propriétés oxydantes, qui leur permettent un certain avenir dans le domaine de la chimie analytique.La chimie du xénonTrois types de composés furent essentiellement isolés: des fluorures, un oxyde, des sels.La synthèse des fluorures, produit de base de toute cette chimie, s’avère particulièrement simple puisqu’elle est possible à partir d’un mélange de xénon et de fluor, soit par irradiation ultraviolette, soit par décharge électrique, soit par simple chauffage vers 350 0C.En fonction des conditions opératoires, quatre fluorures ont été synthétisés, le di-, le tétra-, l’hexa-et l’octofluorure de xénon. Par hydrolyse aqueuse neutre ou acide du tétra-ou de l’hexafluorure, on obtient le trioxyde Xe3:
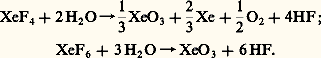 Les sels, ou perxénates, sont formés par hydrolyse basique des mêmes fluorures ou par action d’une base sur une solution de trioxyde:
Les sels, ou perxénates, sont formés par hydrolyse basique des mêmes fluorures ou par action d’une base sur une solution de trioxyde: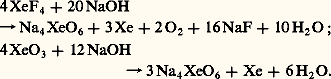 Tous ces composés, à l’état pur, sont des solides blancs cristallisés.Les fluorures sont des oxydants et des fluorants puissants. Ils réagissent sur la majorité des solvants. Le difluorure de xénon possède une certaine solubilité dans l’eau, mais se décompose lentement:
Tous ces composés, à l’état pur, sont des solides blancs cristallisés.Les fluorures sont des oxydants et des fluorants puissants. Ils réagissent sur la majorité des solvants. Le difluorure de xénon possède une certaine solubilité dans l’eau, mais se décompose lentement: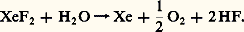 Ils réagissent avec l’hydrogène et donnent, avec les fluorures métalliques, de nombreux composés d’addition tels Xe2, 2 Sb5 ou Xe6,2 NaF et un fluorure mixte Xe2,Xe4.Mais c’est en milieu aqueux qu’interviennent les réactions essentielles qui conduisent à la chimie des composés oxygénés du xénon, comme l’ont montré les préparations. Le trioxyde de xénon est obtenu en solution; celle-ci, exempte de tout corps oxydable, est parfaitement stable. Par contre, sec, ce composé présente des propriétés explosives, comparables à celles du trinitrotoluène, dont les manifestations s’observent à la moindre sollicitation mécanique ou électrique.Des composés d’addition avec les fluorures alcalins (XeO3, 2 MF) ont été isolés et sont thermiquement plus stables puisqu’ils ne se décomposent qu’au-dessus de 200 0C, contre 70 0C pour le trioxyde pur.Stable en milieu neutre ou acide, en milieu basique il conduit aux perxénates, sels où le xénon se trouve à sa valence maximale VIII. On connaît principalement les perxénates de métaux alcalins et alcalino-terreux. Certains auteurs signalent l’existence de perxénates d’argent, de plomb, de cuivre..., mais ceux-ci ne semblent pas parfaitement définis.Tous ces sels sont obtenus sous diverses formes hydratées (Na4Xe6, 8 H2O; Na4Xe6, 2 H2O; K4Xe6, 6 H2O; Ba2Xe6, (3/2) H2O). Rendus anhydres vers 150 0C, ils se décomposent rapidement en milieu acide pour redonner le trioxyde de xénon.Dans des conditions particulières de synthèse, deux composés d’addition ont été obtenus: Na4Xe6, 2 NaF, qui présente un domaine de stabilité très supérieur aux perxénates purs puisqu’il ne se décompose qu’à 500 0C; et K4Xe6, 2 Xe3, qui est un explosif puissant de couleur jaune orangé.Enfin, on peut mentionner un certain nombre d’autres composés: des oxyfluorures tels l’oxydifluorure Xe2, le dioxydifluorure Xe22, l’oxytétrafluorure Xe4; le tétroxyde Xe4; de nombreux composés d’addition des fluorures et des oxyfluorures (XeF2, 2 As5; Xe6, B3; Xe4, 3 KF; etc.).Plus de cinquante composés du xénon sont isolés, et cette chimie, encore très travaillée, ne cesse de s’étendre. Si elle n’offre pas encore de débouché industriel, elle n’en reste pas moins intéressante sur le plan de la théorie des liaisons chimiques après la condamnation de la conception de «gaz inerte».
Ils réagissent avec l’hydrogène et donnent, avec les fluorures métalliques, de nombreux composés d’addition tels Xe2, 2 Sb5 ou Xe6,2 NaF et un fluorure mixte Xe2,Xe4.Mais c’est en milieu aqueux qu’interviennent les réactions essentielles qui conduisent à la chimie des composés oxygénés du xénon, comme l’ont montré les préparations. Le trioxyde de xénon est obtenu en solution; celle-ci, exempte de tout corps oxydable, est parfaitement stable. Par contre, sec, ce composé présente des propriétés explosives, comparables à celles du trinitrotoluène, dont les manifestations s’observent à la moindre sollicitation mécanique ou électrique.Des composés d’addition avec les fluorures alcalins (XeO3, 2 MF) ont été isolés et sont thermiquement plus stables puisqu’ils ne se décomposent qu’au-dessus de 200 0C, contre 70 0C pour le trioxyde pur.Stable en milieu neutre ou acide, en milieu basique il conduit aux perxénates, sels où le xénon se trouve à sa valence maximale VIII. On connaît principalement les perxénates de métaux alcalins et alcalino-terreux. Certains auteurs signalent l’existence de perxénates d’argent, de plomb, de cuivre..., mais ceux-ci ne semblent pas parfaitement définis.Tous ces sels sont obtenus sous diverses formes hydratées (Na4Xe6, 8 H2O; Na4Xe6, 2 H2O; K4Xe6, 6 H2O; Ba2Xe6, (3/2) H2O). Rendus anhydres vers 150 0C, ils se décomposent rapidement en milieu acide pour redonner le trioxyde de xénon.Dans des conditions particulières de synthèse, deux composés d’addition ont été obtenus: Na4Xe6, 2 NaF, qui présente un domaine de stabilité très supérieur aux perxénates purs puisqu’il ne se décompose qu’à 500 0C; et K4Xe6, 2 Xe3, qui est un explosif puissant de couleur jaune orangé.Enfin, on peut mentionner un certain nombre d’autres composés: des oxyfluorures tels l’oxydifluorure Xe2, le dioxydifluorure Xe22, l’oxytétrafluorure Xe4; le tétroxyde Xe4; de nombreux composés d’addition des fluorures et des oxyfluorures (XeF2, 2 As5; Xe6, B3; Xe4, 3 KF; etc.).Plus de cinquante composés du xénon sont isolés, et cette chimie, encore très travaillée, ne cesse de s’étendre. Si elle n’offre pas encore de débouché industriel, elle n’en reste pas moins intéressante sur le plan de la théorie des liaisons chimiques après la condamnation de la conception de «gaz inerte».
Encyclopédie Universelle. 2012.
